目前认为肿瘤细胞的高突变负荷与肿瘤免疫治疗,尤其是免疫检查点阻断剂(ICB)的治疗获益密切相关。无论是肿瘤的驱动突变(driver mutation)还是非驱动突变(passenger mutation)产生了新表位,都有可能激活尚未被耐受的T细胞,引发杀伤肿瘤的T细胞反应。然而有些肿瘤本身就是突变负荷低的“冷”肿瘤,如何增加其突变负荷成为对免疫治疗敏感的“热”肿瘤成了好多免疫学专家探索的方向。
除了外源性的损伤可以导致基因突变,如放疗和化疗。能内源性驱动基因突变的APOBEC3蛋白(胞苷脱氨酶)进入了大家的视野。美国梅奥诊所的团队在小鼠实验证明APOBEC3蛋白过表达的肿瘤全细胞疫苗疗效更好,且后续搭配ICB能使小鼠的肿瘤完全持续的消退。成果发表在2020年的《Nature Communications》上[1]。
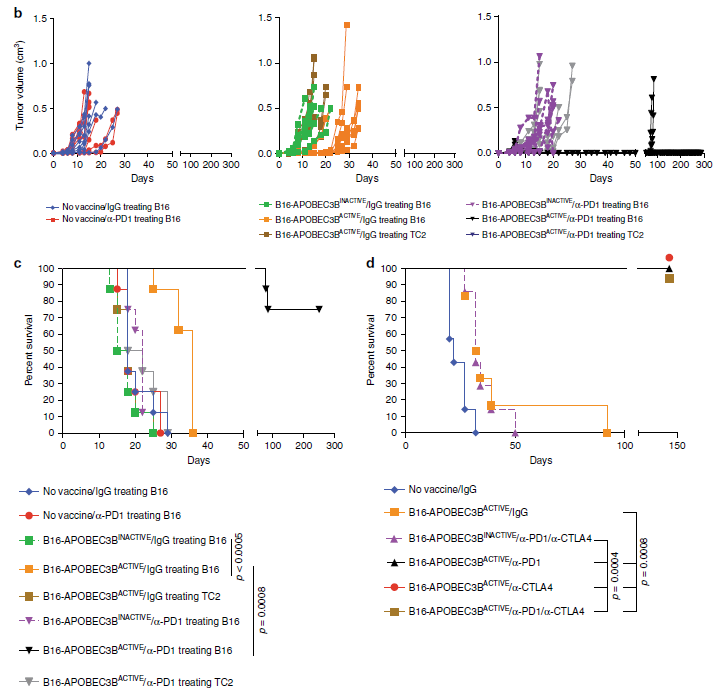
该团队通过慢病毒转染构建了APOBEC3B过表达(APOBEC3BACTIVE)和不表达(APOBEC3BINACTIVE)的两种小鼠B16黑色素瘤细胞系,并能在小鼠皮下稳定成瘤。虽然APOBEC3BACTIVE促使小鼠的黑色素瘤耐受小分子靶向治疗,但它也显著增强了肿瘤对CTLA-4抗体治疗的敏感性。采用APOBEC3BACTIVE的肿瘤细胞裂解物制备全细胞疫苗,相较于APOBEC3BINACTIVE,能显著抑制肿瘤生长和延长小鼠生存期。后续联合ICB可以使小鼠的肿瘤完全消退。
图1:APOBEC3BACTIVE全细胞疫苗联合ICB治疗小鼠黑色素瘤
APOBEC3B诱导的突变可不断产生新表位,这些表位激活的T细胞对亲代、无APOBEC3B修饰的肿瘤也有杀伤作用,ICB能显著增强这个杀伤作用。
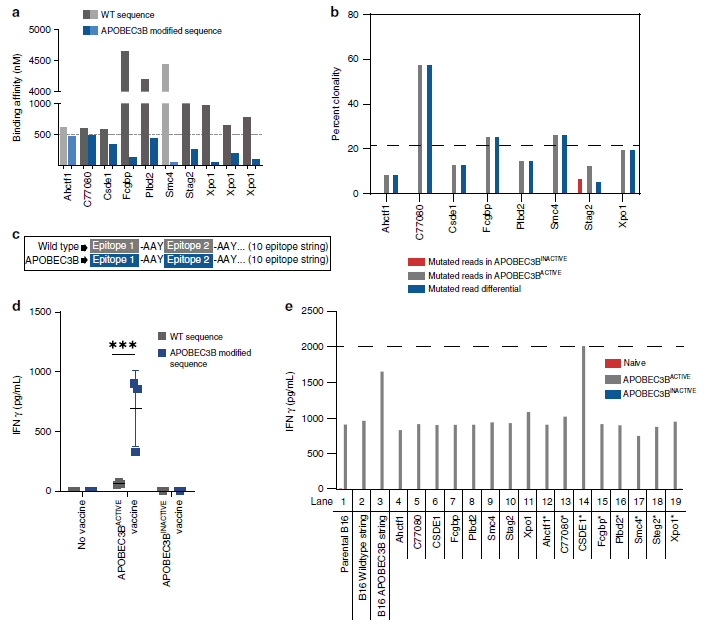
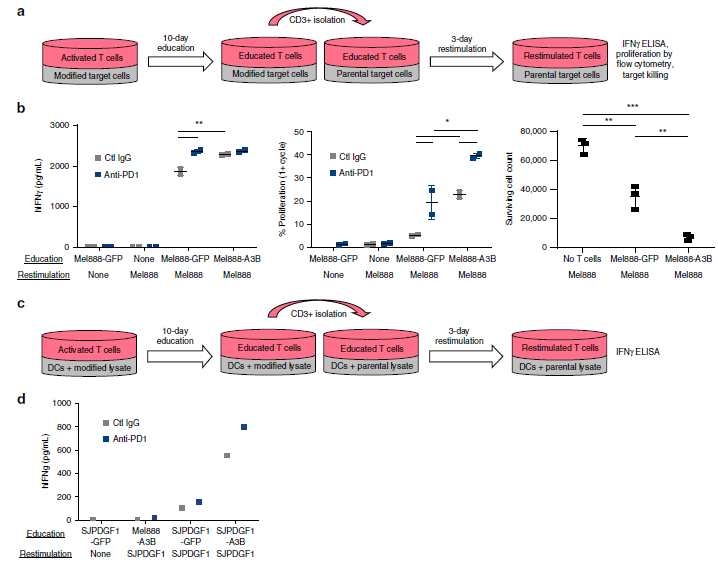
该团队也进行了临床转化的初步探索,人类的肿瘤细胞系体外用APOBEC3B转染修饰后,更易被T细胞识别。
图3:人源APOBEC3BACTIVE全细胞疫苗体外激活人源T细胞
思考:该团队称这个疗法为异质表位激活疗法(heteroclitic epitope activated therapy, HEAT)。由于APOBEC3B是肿瘤基因组多样性的驱动因素,其过度表达可能有两个治疗上相反的结果:一方面,驱动基因的突变可能会产生更具攻击性的克隆,使肿瘤更能耐受一般药物治疗。另一方面,APOBEC3B诱导的突变可能会产生新的免疫原性强的表位,启动T细胞抗肿瘤免疫反应。数据显示APOBEC3B表达升高确实与肿瘤浸润淋巴细胞比例增加有关。该团队认为APOBEC3B修饰带来的免疫治疗上的获益完全可以弥补对传统疗法耐受带来的后果。这一疗法为突变负荷低的肿瘤类型带来了免疫治疗获益的希望。
撰写:褚雁鸿(南京大学医学院附属鼓楼医院肿瘤中心 博士研究生)
审校:刘宝瑞(南京大学医学院附属鼓楼医院肿瘤中心 主任医师 博导)
[1] Christopher B, et al. APOBEC3B-mediated corruption of the tumor cell immunopeptidome induces heteroclitic neoepitopes for cancer immunotherapy. NATURE COMMUNICATIONS | (2020) 11:790.
南京大学鼓楼医院肿瘤中心 主任医师 教授
专注于肿瘤个体化及靶向药物治疗
新抗原疫苗及靶向免疫治疗
精准放疗及中西医结合治疗
原文始发于微信公众号(刘宝瑞肿瘤医疗网络平台):2020文献快递:APOBEC3B修饰—肿瘤疫苗新思路





2020-12-28 17:11 1F
测试